近日,国际权威期刊J. Am. Chem. Soc.在线发表了我校化学与分子科学学院袁荃/杨雁冰教授团队联合中南医院丁召教授在结直肠癌microRNA成像领域的研究成果,论文题目为“Spatially Selective MicroRNA Imaging in Human Colorectal Cancer Tissues Using a Multivariate-Gated Signal Amplification Nanosensor”。武汉大学为论文第一署名单位和通讯作者单位,武汉大学化学与分子科学学院2022级博士研究生张孝明、2024级博士研究生陈文慧以及武汉大学中南医院万松林博士为论文的共同第一作者,武汉大学袁荃教授、杨雁冰教授以及丁召教授为论文共同通讯作者。
结直肠癌(CRC)是一种常见的消化系统恶性肿瘤,是癌症相关死亡的主要原因之一,严重威胁着人类健康。microRNA(miRNA)作为小型单链非编码RNA,是一种重要的内源性基因调控因子,参与了众多生物学过程,其异常表达已被证实与CRC患者的低生存率和远处转移发展密切相关。先前的研究表明,CRC中高水平的miRNA-21能够下调核心错配修复蛋白hMSH2的表达,这将进一步导致化疗药物5-FU诱导的G2/M损伤停滞和细胞凋亡显著减少,最终严重影响CRC患者的治疗效率。因此,对CRC中异常表达的miRNA进行成像是了解其生物学作用机理的一种很有前景的方法。然而肿瘤区域中的靶标miRNA丰度低且大多数靶标miRNA也以不可忽略的水平存在于正常组织中,从而导致成像信背比低下,因此实现精准的靶标miRNA成像仍存在挑战。
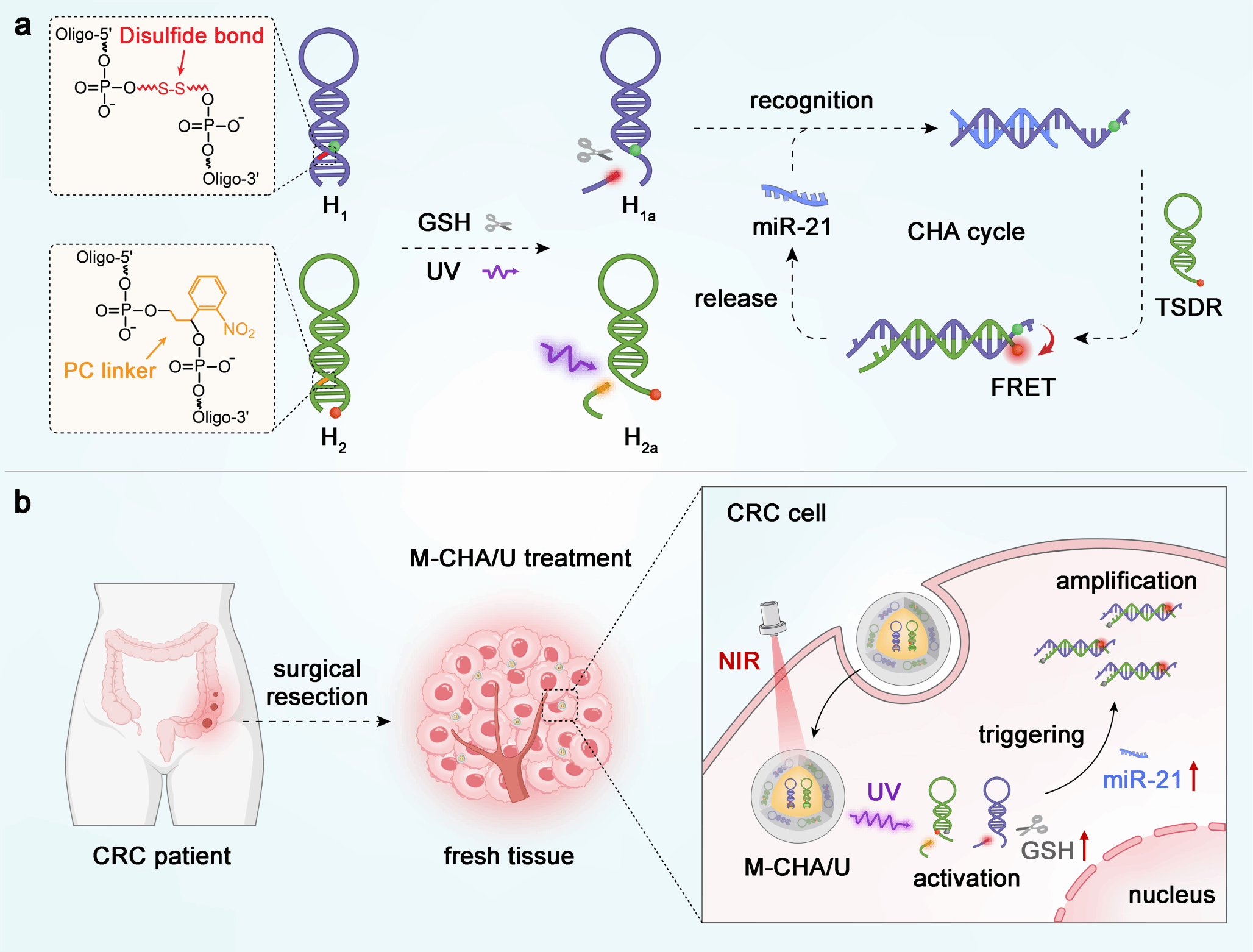
近年来开发了多种能够提高RNA成像灵敏度的信号扩增策略。其中,酶辅助信号放大系统为高灵敏RNA检测提供了机会,但这些系统在进行体内应用时会受到限制。此外,无酶信号放大系统,如催化发夹组装(CHA)系统,因其简单和非酶过程已被提出用于体外和体内的RNA扩增成像。然而,无酶信号放大系统中使用的传统成像探针往往处于持续激活状态,在到达目标区域之前会被目标区域之外少量存在的靶标RNA被动触发,从而产生严重的背景信号干扰,导致成像信背比低下。此外,RNA成像探针在体内进行应用时往往会面临复杂生理环境中的酶降解以及静电膜屏障导致的细胞摄取效率低下等问题。
袁荃/杨雁冰/丁召教授研究团队将多元门控催化发夹组装探针与上转换纳米粒子相结合,开发了一种多元门控信号放大纳米传感器,用于对CRC中的miRNA-21进行特异性放大成像。在设计的纳米传感器中,内源谷胱甘肽门控与外源光门控共同控制催化发夹组装探针的扩增活性,从而有效提高了成像的特异性,降低了背景信号干扰;此外上转换纳米粒子的引入既可作为光转换器又可作为探针的递送载体,从而提高了纳米传感器在活细胞与活体中的摄取效率。因此,相较于原先传统的持续激活型RNA成像探针,该纳米传感器在活细胞及活体中实现了更高的miRNA-21成像信背比与时空精度。作为概念验证,该纳米传感器进一步实现了对人体CRC临床组织学样本中miRNA-21的放大成像以及对肿瘤组织和正常组织的区分鉴别。通过追踪CRC临床组织中的miRNA-21,我们证实了CRC中上调的miRNA-21可抑制DNA错配修复蛋白hMSH2的水平,这为揭示CRC中miRNA-21相关的分子机制提供了依据。此研究中的多门控精准激活与信号放大相结合的miRNA成像策略为疾病相关生物分子分析提供了一种选择,同时对癌症诊断和预后具有重要意义。
该项研究得到了武汉大学科研公共服务条件平台、武汉大学化学与分子科学学院、武汉大学中南医院的支持。该项研究获得了国家自然科学基金委、国家科学技术部、中央高校基本科研业务费专项资金、新基石科学基金会、湖北省科技厅的经费支持。
论文原文:https://doi.org/10.1021/jacs.4c16001